コラーゲンの構造
- 読み方
- コラーゲンのこうぞう
- 英語
- Structure of collagen
- 意味
- 1)コラーゲンの一次構造(アミノ酸配列)
コラーゲンのアミノ酸組成は、ほかの一般的なタンパク質と異なり、グリシンが全アミノ酸残基の約1/3、イミノ酸(プロリンとヒドロキシプロリン)が約2/9を占め、疎水性アミノ酸残基が非常に少ない。なかでもトリプトファンは存在しないし、チロシンもテロペプチド(非ヘリックス部分)中に若干存在するだけである。さらにケラチンタンパク質の架橋成分である含硫アミノ酸もほとんど存在しない。
アミノ酸配列の特徴は、下のように、Gly-X-Yの繰り返しになっている点である。3残基ごとにグリシンが存在するのは、コラーゲンがヘリックス(ラセン構造)を形成する上で必要な条件である。X、 Yは任意のアミノ酸であるが、その種類によりX、 Yを占める頻度は異なっている。ここで重要な点は、プロリンはXの位置に、ヒドロキシプロリンはYの位置に存在していることである。しかし、テロペプタイド部分にはこのような規則的配列はみられない。
-Gly-X-Y- (Gly=グリシン、X=プロリン、Y=アラニン又はハイドロキシプロリン)
2)コラーゲンの二次構造
コラーゲンヘリックス(collagen helix)は、コラーゲンタンパク質の二次構造の一つである。グリシン-プロリン-ヒドロキシプロリンの3アミノ酸配列の繰り返し(Gly-X-Y)からなる三本鎖らせんから構成されている。三本の鎖は、プロリンとヒドロキシプロリンのもつ環状構造であるピロリドン環により安定化されている。ポリペプチド鎖がこのらせん構造を取ると、ピロリドン環は鎖間を広げ、αヘリックスよりも開いた構造を保つ。3本の鎖は水素結合により繫がっているが、水素原子の供給源はグリシンのアミノ基であり、受容源はほかの鎖残基のカルボキシル基である。ヒドロキシプロリンのカルボキシル基も水素結合に関与している。コラーゲン分子の両末端にはランダム構造(二次構造の一つ)が存在し、テロペプタイドと呼ばれている。この部分は、酵素作用を受けやすく、抗原作用に関与している。
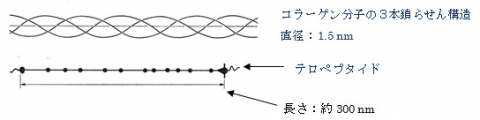
≪コラーゲン分子≫
3)コラーゲンの三次元構造
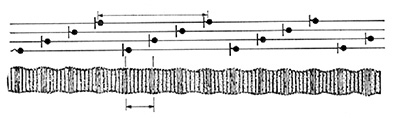
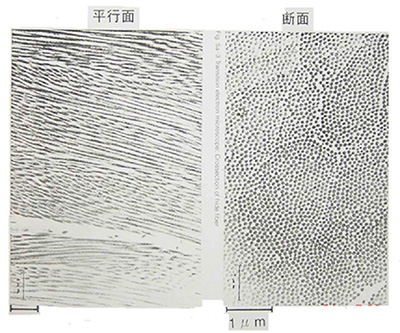
コラーゲン分子が、少しずつずれて集合し、太く長い線維を作る。これはコラーゲン細線維(collagen fibril) と呼ばれる。コラーゲン細線維は透過型電子顕微鏡で観察することができ、ほぼ65 nm周期の縞模様が観察される。下右の写真に見える牛皮コラーゲン細線維断面の電子顕微鏡写真から、その直径は約0.1μm(約100 nm)である。コラーゲン細線維の太さは通常、数十~百数十 nm程度である。この太さは、そのコラーゲン細線維を作っているコラーゲンの各型の割合などによって決まることがわかっている。加脂効果はコラーゲン細線維表面が関与していることが考えられている。
コラーゲン細線維は、さらに多くが寄り集まって、結合組織内で強大な線維を形成する。これがコラーゲン線維(膠原線維<こうげんせんい>)(collagen fiber)である。コラーゲン線維の太さは数μm~数十μmで、適切な染色をおこなうと、光学顕微鏡でも観察することができる。
さらにコラーゲン線維が集合するとコラーゲン線維束(collagen fiber bundle)を形成する。

- 関連リンク
- コラーゲン


 ≪コラーゲン分子≫
≪コラーゲン分子≫